UDI常见问题整合
一、UDI申办的流程
1.选择发码机构及编码体系(注册人/备案人在申请医疗器械注册或者办理备案时,需要在注册/备案管理系统中提交其产品标识,企业可沿用当时的编码体系);
2.进行UDI-DI编码与申报;
3.对UDI-PI进行编码;
4.进行UDI标签设计;
5.将已完成标签设计的UDI打印或喷码;
6.进行UDI标签检测;
7.UDI灵活应用(包装关联、出库防窜、追溯防伪等)。
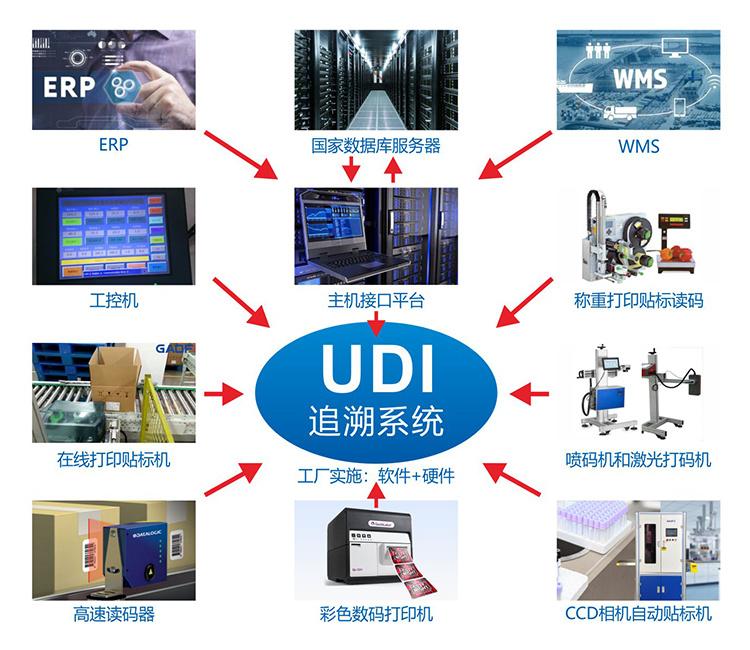
二、上传到药监局是否需要完整的UDI码?
目前药监局医疗器械唯一标识数据库提供3种申报方式:网页填报、批量导入和申报接口,也就是说企业将UDI上传到药监系统有上述3种方式。
三、高赋码UDI软件系统是否需要跟药监局有一个接口?
我们UDI软件支持数据导出,暂时不能跟药监局的数据库对接
四、请问我们输入的UDI的DI部分输出的二维码这个逻辑原来是否按照GS1的标准输出的二维码还是市场上只要是二维码都可以转换?
GS1条码标准是全球供应链管理中的一种标准化自动识别和追溯方式,需要通过专业的软件按照规则进行编码,它包括了一系列规范和标准,用于生成和应用条码标签,实现商品、物流和零售等领域的高效管理。
五、客户只有DI码,怎么实现UDI标签,如何上传到国家药监局系统。
根据产品的属性,允许UDI标签只体现DI部分信息,按照药监局系统数据规则进行上传
六、高赋码UDI系统,是如何实现UDI码,UDI标签?如果把UDI数据上传到国家药监局?
我们的UDI系统首先进行DI部分的产品维护,再定义PI的编码规则,最终生成UDI标签,数据采用导出的形式再上传到药监局系统
七、UDI法规有哪些?UDI标签测试标准?
所谓“医疗器械UDI中只要求DI”指的是只需要在药监局数据库上传DI,PI无需上传。但在赋码时,数据载体需要同时包含DI和PI内容,即需要完整的UDI。
八、UDI标签的测试标签包含:
1.标签材料和打印质量
2.UDI信息的准确性
3.标签粘贴位置和固定性
4.防伪和防水性检验
九、UDI产品包装层级?层级变化后的UDI有哪些变化?
有包装层级的UDI,数据维护时要针对不同的层级赋于不同的DI也就是GTIN(01)数据不能是一样的
医疗器械UDI需要在医疗器械最小销售单元和更高级别的包装或者直接在医疗器械产品本体上赋予唯一标识数据载体。也就是说,如果某产品只有一个包装层级,那么可以只将完整的UDI码印在外包装盒上。但如果产品有多个层级包装,则需要在最小销售单元及更高级别的包装进行赋码。



