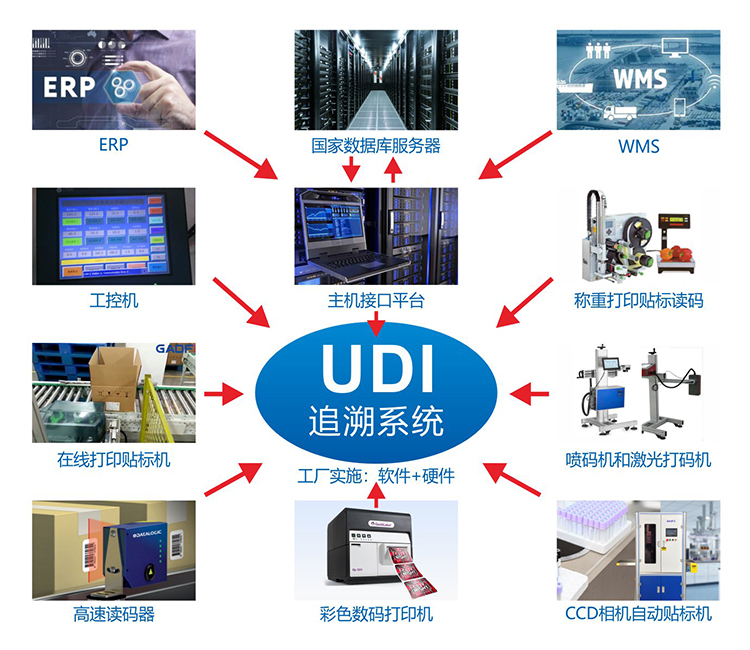
“一物一码”技术应用在医疗器械行业,就是医疗器械唯一标识UDI,其目的是建立医疗器械产品全生命周期监管体系,加强对医械产品的质量监督。
完整的UDI系统包括UDI编码、UDI数据载体和数据库: UDI编码是一串全球唯一的代码,是医疗器械的数字“身份证”。 UDI数据载体是UDI编码的表现形式,如一维码、二维码等。 UDI数据库是储存UDI编码信息的数据库。 三者共同构成U D I体系。
 近年来,UDI在世界各国迅速推广,中国、美国、欧盟、日韩等国家和地区纷纷要求在本国销售、流通的医疗器械必须具备UDI。本期先来聊聊UDI的国际发展情况。
近年来,UDI在世界各国迅速推广,中国、美国、欧盟、日韩等国家和地区纷纷要求在本国销售、流通的医疗器械必须具备UDI。本期先来聊聊UDI的国际发展情况。
2011年国际医疗器械监管机构论坛(IMDRF)成立,2013年12月发布《UDI指南》、2019年3月发布《医疗器械唯一标识系统应用指南》,为建立全球互认的UDI系统提供了技术框架。
美国早在2007年《FDA修正案》就正式确立了实施UDI的立法依据。2012年7月发布《UDI法规提案》,2013年9月发布《UDI最终法规》,计划用7年时间对不同医疗器械产品分阶段推进并逐步实施UDI管理。 目前,美国已基本实现所有医疗器械产品的UDI覆盖。这也意味着,出口美国的各类医疗器械全部需要实施UDI。
欧盟在2013年4月发布《UDI系统通用框架的指导意见》,2017年5月发布《医疗器械法规》(MDR),对医疗器械基于UDI的追溯管理提出要求,并计划分阶段实施UDI。 随后,欧盟数据库逐步完善各功能板块并开放注册,2022年5月26日,数据库开放UDI板块,要求MDR的Ⅲ类产品申报DI。2023年5月26日,实施范围扩大到了MDR的Ⅱa、Ⅱb、Ⅲ类-可重复使用产品、IVD的Class D产品。
日本厚生省于2018年3月发布通知《医疗器械标识代码放置指南》,用3年按照风险等级逐步推进,并建立了国家数据库。
韩国已完成了各类医疗器械的合规进程。出口韩国的各类医疗器械都需要完成UDI实施。
沙特阿拉伯要求在2023年9月1日前,D类(高风险)、B/C类(中等风险)需要完成UDI合规。
中国台湾要求,截止日期2023年6月,Ⅱ类医疗器械需要完成UDI合规。
除以上国家或地区外,越来越多的国家或地区也陆续发布了UDI相关法规。



