2项医疗器械唯一标识UDI新标准来了,征求意见稿已发布!
中国食品药品检定研究院发布了关于征求《医疗器械唯一标识的形式和内容》等2项医疗器械行业标准(征求意见稿)意见的通知,于2023年11月04日前公开征集意见。
上述2份医疗器械行业标准分别为《医疗器械唯一标识的形式和内容》和《医疗器械唯一标识的包装实施和应用》,分别在UDI解析与识读与包装层级方面给出了相关指导性意见。
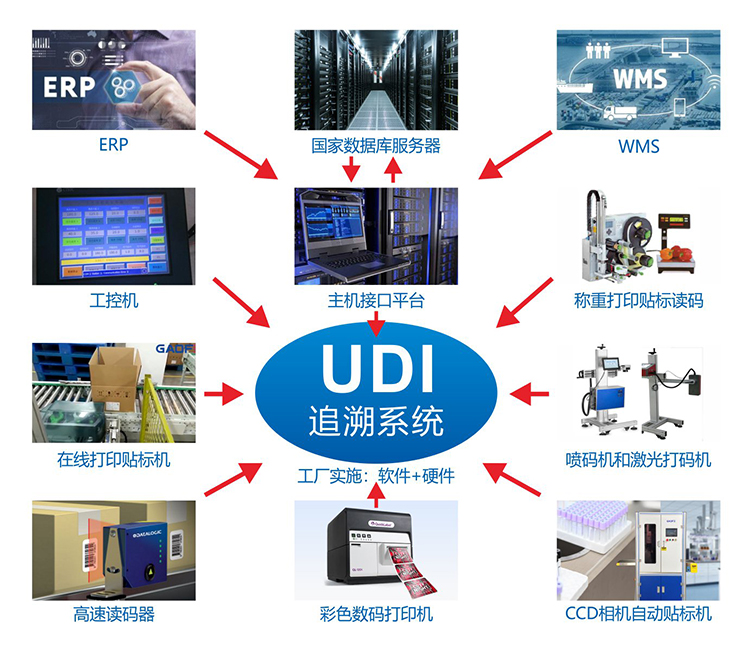
在医疗器械唯一标识实施过程中,由于识读设备系统兼容难的问题普遍存在,一些流通和使用单位存在系统不能识别制造商的条码、无法形成条码化管理系统的现象,极大的影响了各方实施唯一标识制度的积极性,导致部分流通企业和医院依然通过自编码的形式开展医疗器械的管理,额外增加了实施成本、增加了错误识别的可能性。
因此,《医疗器械唯一标识的形式和内容》旨在通过规范唯一标识的形式和内容以及在多码并行情况下唯一标识的识读和解析,解决当前企业混淆唯一标识和标签内容,以及将唯一标识和标签内容融合导致不符合发码机构标准要求导致的条码无法识读的现象,从而提升医疗器械全环节唯一标识的规范程度,通过打通整个供应链,提升各方实施唯一标识的积极性,促进三医联动。
此外,在当前唯一标识制度实施中,仍存在医疗器械的各产品包装级别唯一标识的创建、赋予和数据上传不规范的问题,各层级包装没有单位数量换算逻辑关联,致使相关方只能采取通过识读最小销售单元包装 UDI 进行相关信息采集,严重降低影响了医疗器械的在各环节的流转入库效率,降低了各方实施和应用唯一标识的积极性。
由于不同医疗器械包装形式不同,且供应链中不同环节接触到的产品包装级别存在差异,《医疗器械唯一标识的包装实施和应用》针对最小销售单元和使用单元一致以及最小销售单元包含多个使用单元两种代表性的情况,给出了唯一标识的包装实施以及在供应链中的解析方法,各相关方可以根据自身的需求和应用场景参照标准提供的方法实施和应用UDI。



