随着第三批医疗器械产品实施工作的开启,和多个省市的政策的先一步推进,不少二类甚至一类医疗器械企业开始着手准备医疗器械唯一标识(UDI)的实施工作。但由于缺少相关经验,加之政策法规细则较多,大多数医疗器械企业反映在学习或者实施难度都比较大。那么,到底该如何申请UDI呢?我们为大家整理了一份UDI申请操作指南,以供大家参考:
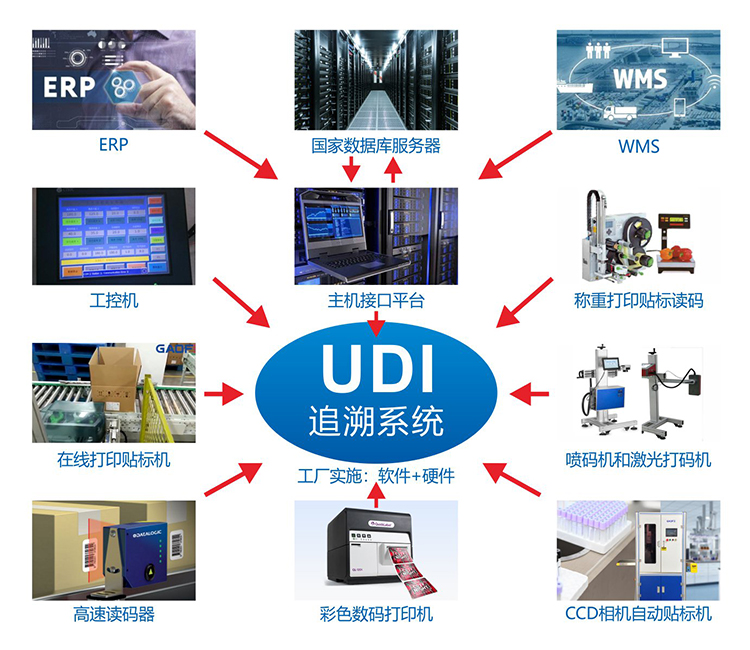
步骤一:确定UDI实施的产品范围、注册人/备案人
UDI 实施范围见 2019 年《国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告》、2020 年《国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》、2021 年《国家药监局 国家卫生健康委 国家医保局关于做好第二批实施医疗器械唯一标识工作的公告》,2023年以及国家药监局的相关文件要求。
“医疗器械注册人 / 备案人,是指取得医疗器械注册证或者办理医疗器械备案的企业或者研制机构”——《医疗器械监督管理条例》(中华人民共和国国务院令第 739 号)。
步骤二:申请厂商识别代码
首先,企业需要申请成为GS1系统成员,也就是申请UDI-DI厂商识别代码。申请方式分为线上及线下两种。线上主要是通过登录中国物品编码中心网站进行申请;线下可以携带企业法人营业执照或营业执照副本及复印件,前往企业注册所在地编码分支机构窗口办理。
步骤三:分配产品标识
为医疗器械最小销售单元和更高级别的包装或者医疗器械产品分配 GTIN。当最小销售单元中使用单元的数量大于 1 时,应同时为使用单元分配 GTIN。确保 GTIN 在数据库中存储为 14 位,若使用 GTIN-13 应在前面补“0”。
物流包装如需编码可使用系列货运包装箱代码(SSCC),详见《商品条码 物流单元编码与条码表示》(GB/T 18127 — 2009)。
步骤四:分配生产标识
根据监管和实际应用需求,确定生产标识是否包含医疗器械序列号、生产批号、生产日期、失效日期等。器械种类不同,生产标识可能不同。
步骤五:UDI标签打印与检测
企业可以登录UDI服务平台进行UDI标签制作,平台为企业提供多种规格的标签样式模板及个性化标签设计制作功能。制作结束后,企业需要将UDI唯一编码通过打印设备完成打印并附在产品包装上。需要注意的是,不同的赋码设备,包装不同,操作模式也不同,企业需要根据自己的产品进行赋码设备的选择,比如目前主流可以满足医疗器械行业的需求的打印机有:台式热转印打印机、在线热转印TTO、UV喷码机、激光打印机、热发泡喷码机。
同时,根据相关法规、标准、《GS1 通用规范》以及《GS1 医疗 AIDC 实施指南》等确定条码印制质量、人工识读内容和载体放置位置等细节,对条码、RFID 标签质量进行检测。
步骤六:提交 UDI 数据
申请首次注册、延续注册或者注册变更时,注册申请人 / 注册人应当在国家药品监督管理局注册管理系统中提交其最小销售单元的产品标识。
上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至国家药监局医疗器械唯一标识数据库。
步骤七:关联医保数据
对于已在国家医保局医保医用耗材分类与代码数据库中维护信息的医疗器械,要在唯一标识数据库中补充完善医保医用耗材分类与代码字段,同时在医保医用耗材分类与代码数据库维护中完善医疗器械唯一标识相关信息,并确认与医疗器械唯一标识数据库数据的一致性。
步骤八:维护数据
当医疗器械最小销售单元产品标识相关数据发生变化时,注册人 / 备案人应当在产品上市销售前,在医疗器械唯一标识数据库中进行变更,实现数据更新。
医疗器械最小销售单元产品标识变化时,应当按照新增产品标识在医疗器械唯一标识数据库上传数据。



