疗器械唯一标识(unique device identifier,UDI)目前已成为解决医疗器械全球监管问题的通用语言。自2013年9月美国食品药品管理局(Food and Drug Administration,FDA)发布医疗器械唯一标识系统(unique device identification system,UDI system)法规、正式启动UDI实施工作以来,规范医疗领域数据格式,提高临床数据釆集的准确性,同时也为UDI全球协调工作提供了经验。本研究拟结合本所研究人员亲赴FDA展开的UDI调研情况,系统概述美国UDI系统实施的法规体系和组织架构以及UDI系统项目推进情况,研讨美国UDI系统的具体实施方案,分析UDI发码机构、全球UDI数据库等美国特色的UDI系统实现方式,为我国开展和推进UDI实施工作提供借鉴和思路。
Progress in the Implementation of Unique Device Identification(UDI)System in the US
YI Li,YU Xinhua*
(Institute of Medical Device Standardisation Administration,National Institutes for Food and Drug Control,Beijing 100050,China)
[Abstract]The unique device identifier(UDI)has become the common language for identification of medical device globally.Since September 2013,the US Food and Drug Administration( FDA)issued unique device identification system(UDI system)regulations to establish a UDI system,which not only standardized data formats for healthcare industry and improved the accuracy of collecting clinical data,but also provided experience for UDI's global harmonization efforts.Combining with the experience from the field study to US FDA about UDI in 2016,this article outlines the regulatory system and organizational structure of UDI system implementation and the promotion of UDI system projects,discusses the specific implementation plan of UDI system in the United States,and analyzes the UDI issuing agency and global UDI database.The UDI system implementation method with United States characteristics provides experience for China to carry out and promote the implementation of UDI system.
[Key Words]Unique device identifier(UDI);The US Food and Drug Administration;UDI system regulatory system and organizational structure;UDIsystem project promotion
医疗器械唯一标识(unique device identifier,UDI)目前已成为解决医疗器械全球监管问题的通用语言。国际医疗器械监管机构论坛(international medical device regulators forum,IMDRF)于2013年12月发布《UDI指南》【1】,拉开了全球实施UDI的序幕。由于《UDI指南》只是一个框架性文件,不包括具体应用层面的指导,2017年9月,IMDRF重开UDI工作组,并于2019年3月发布《UDI应用指南》和两个信息文件《在电子健康系统中记录UDI)<UDI数据元素在不同IMDRF成员国的使用》,给各国实施UDI提供细化的指导。
我国国家药品监督管理局(NMPA)于2019年8月发布《医疗器械唯一标识系统规则》
【2】,自2019年10月1日起正式实施。全球范围内,美国、欧盟、沙特阿拉伯和韩国等国家和地区也已经发布UDI相关的法规和指导性文件。美国是首个在国家层面、由政府以法规形式实施医疗器械唯一标识系统(unique device identification system,UDI system)项目的国家,当前已经实施6年。现本研究拟结合本所研究人员亲赴美国食品药品管理局(Food and Drug Administra tion,FDA)展开UDI调研的情况,系统概述美国UDI系统实施的法规体系和组织架构以及UDI系统项目推进情况,研讨美国UDI系统的具体实施方案,分析UDI发码机构、全球UDI数据库等美国特色的UDI系统实现方式,为我国开展和推进UDI实施工作提供借鉴和思路。
1、美国FDA UDI法规制定背景和现状
1.1美国FDAUDI实施背景
1999年,美国国家医学院(Institute of Medicine)发布了研究报告《人非圣贤》,报告指出,错误地使用药物和器械导致的医疗错误是医疗事故的主要原因,而医疗错误大多是可以避免的,通过床前扫码能够有效地避免药物和器械的误用,从而极大程度地降低医疗成本。本研究报告是美国FDA积极推行药品和医疗器械条形码管理的契机【3】。
2004年,FDA颁布法规,要求在药品标签上使用条形码识别,在起草时,FDA针对是否应将此项法规推广至医疗器械领域公开征求了意见,在审议过程中,FDA决定不对医疗器械应用条形码规则,并表示此类器械缺乏与国家药品代码(national drug code)系统相类似的标准和唯一识别系统,但UDI有助于减少医疗错误,便于召回,可识别器械的兼容性或过敏反应(如MRI和乳胶)、改善库存控制、完善报销方式并减少假冒产品。FDA一直在积极开展相关研究,推动UDI的实施,并委托相关咨询机构开展研究,发布了研究报告,并开展了法规实施的影响力分析,认为UDI实施利大于弊【4】。
1.2美国FDA实施UDI的法规体系
基于之前的研究成果,2007年《FDA补充法案》【5】确立了美国FDA实施UDI系统的法规依据,明确了可以发布UDI法规,要求在医疗器械的标签上赋有唯一性的标识,以便在流通和使用环节充分识别医疗器械。2012年《FDA安全和创新法案》【6】确立了UDI系统实施的时间框架,要求UDI法规草案在2012年12月31日前完成,并在征求意见结束后6个月内发布,植入器械、生命支持/生命维持类器械需要在法规发布后两年内实施UDI。2013年9月,FDA发布UDI法规,计划通过7年时间逐步实施UDI。
2013年IMDRF发布的《UDI指南》明确提出,所有UDI应用的利益相关者(从生产企业到医疗机构和患者),只有在其各工作流程系统中使用UDI,才能体现出UDI的益处。UDI规则发布后,美国同时也对联邦法规第21篇(Code of Federal Regulations Title 21,21CFR)做了一系列适应性修订,在诸多章节中加入了UDI相关内容,例如第803部分——医疗器械报告,第810部分——医疗器械召回主管机构,第820部分——质量系统法规等,促进各方在相关环节应用UDI,从而最大程度发挥UDI的作用。FDA陆续发布了一系列指南性文件,指导企业实施UDI。
指南文件包括唯一标识的关键性要求,例如数据库填报、关键性技术(如针对医疗器械本体直接标识等)以及特定类型的医疗器械产品(如针对器械包发布的指南等)。FDA并没有在法规规则的同时一次性发布所有的指南,而是在UDI实施过程中,结合产品的合规日期逐步发布。见表1。
2、美国FDAUDI实施情况
2.1美国FDAUDI施行组织架构
美国FDA成立了专门的UDI工作团队,具体由FDA设备仪器与放射健康中心(Center for Devices and Radiological Health,CDRH)的监管和统计办公室(Office of Surveillance and Biometrics,OSB)和FDA信息化办公室负责。美国UDI数据库的公众查询平台是由FDA与美国国立医学图书馆合作建立,可供公众免费查询、数据库下载等。
2.2发码机构的认可情况
美国FDAUDI规则在很大程度上依赖于国际标准和全球公认的发码机构。FDA要求UDI的发码机构能够满足以下条件:①为非盈利私人机构或者国家机构;②符合ISO/IEC15459标准的2、4、6部分;③仅使用来自ISO/IEC646标准中的字符和数字;④对所有的使用者一致、公正和合理;⑤能够协调各利益相关方之间的冲突,该冲突将妨碍申请人构建一个公平和中立标识系统。
美国FDA对发码机构采取的是认可的方式,满足条件的发码机构需向FDA提供书面的申请,并按照要求提供材料和支持文件。FDA认可发码机构的期限是3年,到期后可以申请更新,FDA保留撤销认可的权力。发码机构需要保存贴标商列表并在每年12月31日前以电子文档的形式向FDA提供该列表。目前,FDA认可了国际物品编码组织(GS1)、健康行业商务通信委员会(HIBCC)和国际血库自动化委员会(ICCBBA)3家发码机构。在数据库中,根据FDA2016年7月数据,采用GS1作为发码机构的数据约占80%,HIBCC数据约占20%,MICCBBA数据只有1~2条记录,基本可以忽略不计。
表1 美国FDAUDI相关法规、文件和合规日期

注:除2015年9月24日需要合规的植入/生命支持/生命维持的医疗器械外,其他类型的医疗器械若需本体直接标识要求,合规日期为同类产品合规日期后两年
2.3UDI数据库的建设情况
2013年9月20日,美国UDI数据库正式上线,当时并未开放公众在线查询功能。美国FDA于2014年6月发布UDI数据库指南,指导行业上传相关数据,指南发布的时间为在首批产品实施UDI前3个月,对首批需要合规的企业具有很好的指导作用。2015年5月4日,FDA与美国国立医学图书馆合作,发布了GUDID公众数据平台(Access GUDID),可供公众免费査询、数据库下载等。数据库运行至今,经过多次的更新,截止至2019年9月,已经由最初发布时的1.0版更新到最新的2.4.6版【7】。
3、美国FDA UDI实施的经验
3.1美国FDA UDI成功实施的关键因素
美国FDA咨询系统(FDA helpdesk)是UDI法规实施获得成功的关键因素之一。截至2016年7月25H,UDI咨询系统总共收到超过20000个问题,超过95%的问题已经成功解答。目前,FDA平均每个月会收到1300个问题,在新的实施日期到来时,收到的提问会增加。赴FDA调研时,按照提问的总类,位于前3位的问题分别是监管政策、技术和账户相关的问题。当前,由于数据库数据量逐渐增加,FDA新设置了数据质量问题的选项。FDA会对收到的问题进行分类,并对比以往回答的问题中是否有相似的问题,从而加快问题回答的速度;对于共性问题,FDA还制定了UDI常见问题集,提高企业对UDI的理解。
工作人员保障充足。美国FDAUDI系统实施的核心团队有工作人员10人,特定类别医疗器械合规截止日期前,数据量和问题会急剧上升,FDA会招聘临时工作人员,借以保障工作人员的充足。
积极沟通交流形成良好的实施氛围也是至关重要的。美国FDA在法规制定和实施过程中多次召开研讨会,征求企业的意见,并发布一系列指南和网络教程。此外,行业组织自发形成联盟,积极探讨UDI实施有关问题,借以加强行业之间的沟通和交流,例如医疗保健资源和材料管理协会(The Association for Health Care Resource & Materials Man- agement,AHRMM)是医疗保健供应链专业人员的行业协会,其是美国医院协会的组成部分,开发了学习UDI社区(LUC)【8】,着重讨论如何在医疗保健领域实施UDI。
3.2美国FDA UDI实施面临的挑战
①数据维护及质量问题。医疗器械产品的上市状态和新规格型号的不断更新推出、企业的兼并重组等都会导致数据库信息发生变化,因此UDI数据库需要长期的更新和维护。与此同时,数据质量是UDI全面实施面临的主要挑战,虽然美国FDA在建立UDI数据库中尽可能采取结构化的数据,如是否和下拉选项等方式,避免使用纯文本,但企业填写中还是存在不规范的现象,数据质量有待提高。
②部分企业合规难。据介绍,美国有8000家本土医疗器械生产厂商,全球范围内注册企业有16000家,有3000家进口商。虽然FDA针对小企业发布了(UDI系统:小企业依从性指南》,但因为企业类型、所处区域等不同,同时涉及到硬件购买以及人员培训等,某些企业符合UDI规定尚有困难。对于一些特殊的医疗器械,如标签尺寸过小无法张贴UDI标识的问题、组合包贴标问题、零售商现有扫码系统不兼容等都给UDI实施带来新的挑战。
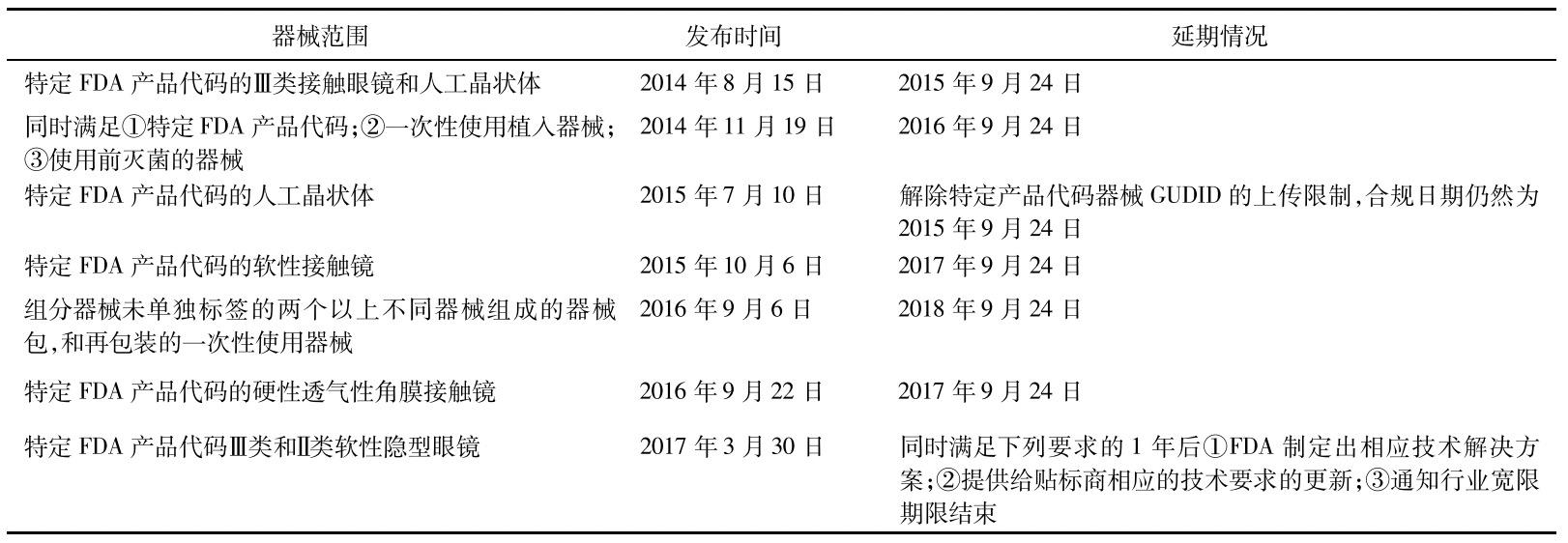
③部分类别医疗器械实施难度大。虽然美国FDA UDI法规明确了各类型医疗产品的合规日期,但是在实施UDI的过程中,由于医疗器械的多样性,部分类型产品难以满足法规要求,美国FDA发布了一系列的通知,推迟了特定类型产品的合规日期,对于某些特殊类别的产品,如软性接触镜,FDA反复推迟实施日期直至寻找到合适的解决方案。见表2。
表2 美国FDAUDI系统特定产品合规日期的调整
4、美国FDA实施UDI对我国的启示
美国FDA UDI法规已经发布6年时间,实施过程中有很多经验可以借鉴,同时也暴露了一些问题需要重视和思考:
①UDI系统是一个医疗器械的充分识别系统,而不是追溯系统,由标识、载体和数据库组成。数据库是一个静态数据库,只包含产品的特征信息,不包括厂商的生产计划、产品流向等动态信息。但如果各方都在他们的工作流程系统中记录和使用UDI,就可以形成完整的追溯链条。
②由于医疗器械的多样性,美国FDA UDI系统规则只是一个框架,给予企业实施更多的灵活性。但美国FDA也在实施过程中发布了一系列指南文件,借以更好地指导企业实施UDI。
③UDI实施是一个长期的系统性工程。美国从开始UDI研究到规格正式发布用了10多年的时间,法规发布后采取基于风险分阶段实施的方式,前后加起来超过20年,UDI的实施应当循序渐进。
④沟通和交流有助于UDI的成功实施。美国FDA在法规制定和发布后大量并多次征求意见和召开讨论会,美国的协会也自发成立了组织研究UDI实施中遇到的问题,形成了良好的实施氛围。
⑤实施中的共性问题有必要明确。UDI实施中很多问题具备普遍性,如在实施初期政策法规和技术问题比较多,美国FDA针对UDI系统实施中的共性问题,制定了UDI常见问题集,有效地指导了行业的合规。



