首先,我们先来简单回顾下目前第二批UDI的政策要求。
国家药监局《关于做好第二批实施医疗器械唯一标识工作的公告(2021年第114号 )》中将所有第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围。并规定2022年6月1日起,生产的医疗器械应当具有医疗器械唯一标识。
上述政策实际上已经明确了第二批医疗器械唯一标识的要求和截止时间。
与其他明确类别的医疗器械相比,在医用耗材领域则又有一些不同,许多企业拿不准医用耗材需不需要实施医疗器械唯一标识(UDI)。
其实,我们可以从医用耗材的定义出发,可以判断医用耗材是否属于UDI的实施范围内。
国家卫建委发布的《医疗机构医用耗材管理办法(试行)》中定义的医用耗材: 是指经药品监督管理部门批准的使用次数有限的消耗性医疗器械,包括一次性及可重复使用医用耗材。
这里的定义将医用耗材归类为消耗性医疗器械,也属于医疗器械。
《医疗机构医用耗材管理办法(试行)》也指出: 医用耗材的临床使用,分三级管理。按照国家药品监督管理局《医疗器械分类目录(该目录将医疗器械分为I、Ⅱ、Ⅲ类)》,将医用耗材分为I、Ⅱ、Ⅲ级。
因此医用耗材风险等级的分类也与UDI的分类要求相契合,这意味着所有的三类医疗器械耗材都需遵守医疗器械唯一标识(UDI)工作实施要求,按时完成UDI合规实施。
此外早在《第一批实施医疗器械唯一标识工作有关事项的通告》中给出的医疗器械唯一标识产品清单中就以高值医用耗材居多,由此也不难看出,医用耗材实施UDI的重要性。
这里的医用耗材指的是耗材本身就是医疗器械的情况,其实施要求和其他三类医疗器械并无不同。
不过,除了可单独销售使用的医用耗材外,更多的耗材可能是作为组合类医疗器械的附件存在,那么此时这些耗材还需要实施UDI并进行赋码吗?
根据耗材不同的存在情况,这里分享两种常见的耗材实施UDI的判断方式。
根据注册证判断
作为组合类医疗器械中的耗材无单独注册证,那么耗材可不分配DI也可分配DI,赋码情况可根据市场情况而定,就目前而言耗材赋码与不赋码皆不影响合规性。
作为组合类医疗器械中的耗材无单独注册证但需要单独销售的,那么耗材需要分配DI同时也需要单独赋码。
根据销售情况判断
组合类医疗器械在销售时按照整体销售,不可将耗材单独拿出销售,则仅需为组合类医疗器械整体实施UDI,耗材无需分配DI及赋码。
合类医疗器械在销售时既可按照整体销售,也可将耗材拿出来单独销售,那么耗材则需要实施UDI。
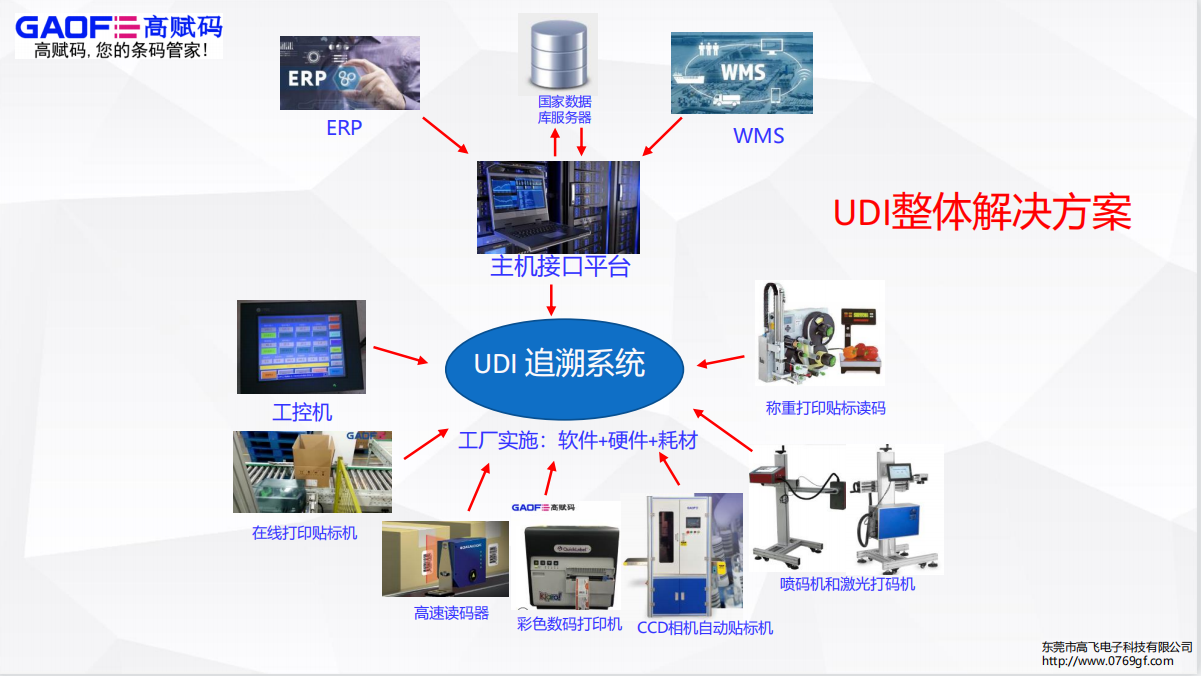
以上为一般性医用耗材企业实施UDI的分类赋码情况,企业可进行相关参考。不过由于各企业产品情况各不一样,更准确合规的实施方案须在具体场景下具体情况具体分析,想要了解更多详细对症内容可咨询高赋码。



