近日,国家药监局发布了《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》,这两份文件皆自2022年5月1日起正式施行。此外,2014年7月30日原国家食品药品监督管理总局令第7号公布的《医疗器械生产监督管理办法》和第8号公布的《医疗器械经营监督管理办法》同时废止。
两份文件主要规定:医疗器械分类管理、医疗器械生产/经营与许可备案管理、医疗器械生产/经营质量管理、医疗器械监督检查、医疗器械注册人/经营者的法律责任等等。
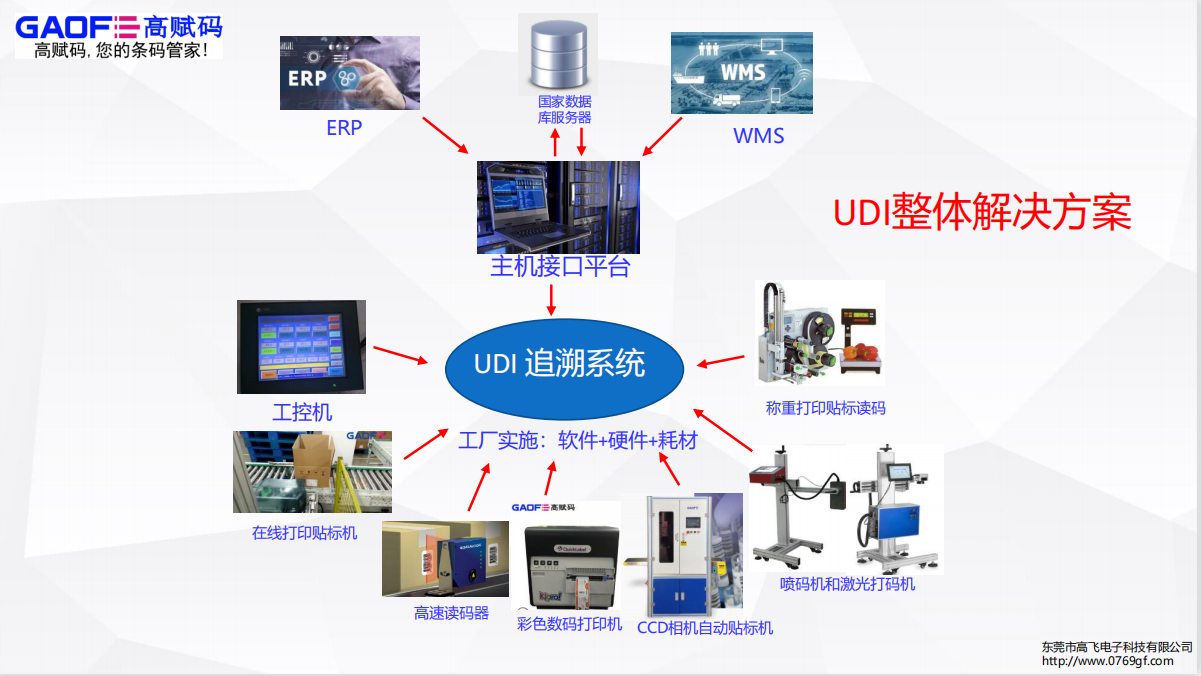
关于医疗器械唯一标识的落实,也分别在两份文件里有提及。
《医疗器械生产监督管理办法》
第三十五条
医疗器械注册人、备案人应当建立并实施产品追溯制度,保证产品可追溯。受托生产企业应当协助注册人、备案人实施产品追溯。
第三十六条
医疗器械注册人、备案人、受托生产企业应当按照国家实施医疗器械唯一标识的有关要求,开展赋码、数据上传和维护更新,保证信息真实、准确、完整和可追溯。
第七十九条
有下列情形之一的,由药品监督管理部门依职责责令限期改正;拒不改正的,处1万元以上5万元以下罚款;情节严重的,处5万元以上10万元以下罚款:
(一)未按照本办法第十六条的规定办理医疗器械生产许可证登记事项变更的;
(二)未按照国家实施医疗器械唯一标识的有关要求,组织开展赋码、数据上传和维护更新等工作的。
《医疗器械经营监督管理办法》
第三十条
医疗器械经营企业应当建立并实施产品追溯制度,保证产品可追溯。医疗器械经营企业应当按照国家有关规定执行医疗器械唯一标识制度。
上述这两份文件分别规定了医疗器械注册人和医疗器械经营企业在医疗器械唯一标识实施方面的义务和违法处罚条款,有效规范了医疗器械唯一标识的落实制度。



