国家药监局(2021年9月17日)发布的《关于做好第二批实施医疗器械唯一标识工作的公告》中,明确将所有第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围并规定了2022年6月1日完成的时间节点。
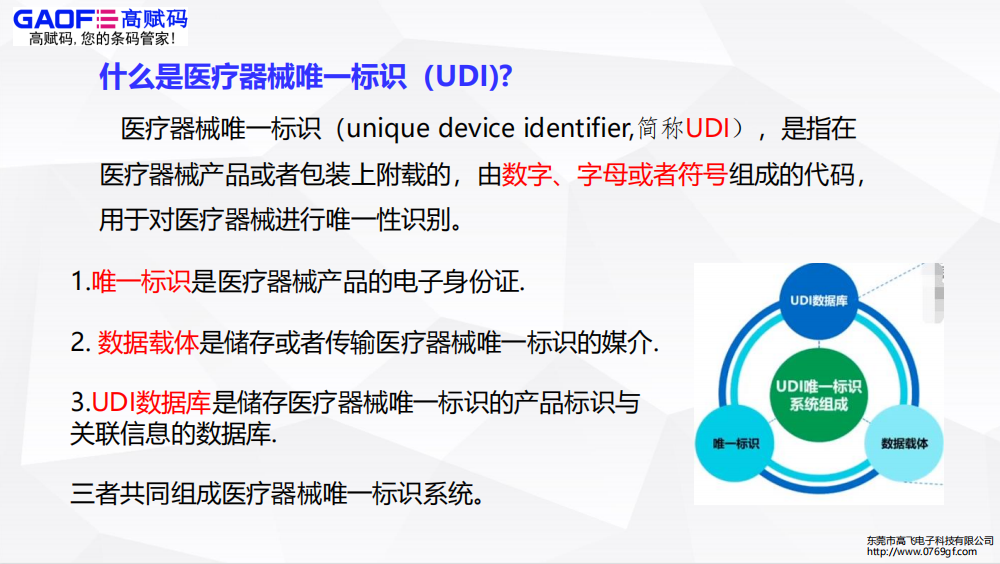
即在国家局的层面上,要求全国所有三类医疗器械在今年6月1日前,必须全部完成UDI实施。同时,这也意味着距离全国一类和二类医疗器械的实施也更进了一步。
此外,北京、重庆、海南、吉林、江西、山西等省市还单独发布了关于医疗器械唯一标识第二批实施工作的通知。部分省市根据本省实际情况,在实施品种范围和时间节点上有一些具体要求。
下面一起来回顾下各省市UDI实施的时间节点和重点要求吧!
海 南
海南省药监局高度重视医疗器械唯一标识试点实施工作,提出:力争实现唯一标识在生产企业和产品品种的“双覆盖”,即:全省所有第三类、第二类生产企业全覆盖以及全省第三类、第二类品种全覆盖,同时鼓励第一类器械生产企业试点。
在《关于联合推进医疗器械唯一标识实施工作的通知》提到: 2021年12月1日起生产的第三类医疗器械; 2022年6月1日起生产的第二类医疗器械都应当具有医疗器械唯一标识。
自2021年12月1日起,第三类医疗器械(含体外诊断试剂)申请首次注册、延续注册或者注册变更时,注册人应当在国家药品监督管理局医疗器械注册管理系统(eRPS系统)中提交其最小销售单元的产品标识。
吉 林
吉林省药监局印发《吉林省推进医疗器械唯一标识系统全域试点工作方案》通知,提到:
第三类医疗器械(含体外诊断试剂)产品全面实施唯一标识,结合试点单位实际,鼓励我省第二类医疗器械产品逐步开展赋码。
山 西
《山西省药品监督管理局办公室关于全域推进医疗器械生产经营环节实施医疗器械唯一标识工作的通知》要求:
第三类医疗器械注册人要在2022年6月1日前将医疗器械唯一标识工作完成情况形成书面报告报山西省药监局医疗器械监管处。试点医疗器械经营企业要实现第三类医疗器械产品扫码入库、出库并进行记录。
四 川
四川省药监局《关于联合推进实施医疗器械唯一标识工作的通知》中提到:实施唯一标识品种为全省医疗器械生产企业注册生产的全部第三类医疗器械品种及《第一批国家高值医用耗材重点治理清单》内品种。鼓励本省医疗器械生产企业将第二类医疗器械纳入实施范围。
提前安排唯一标识工作进度的时间节点,最迟2021年12月需完成检查验收,并提出在2022年1月总结唯一标识工作经验。
此外,医疗器械生产企业自2022年1月1日起,申报第二类医疗器械产品注册的,同时将产品的最小销售单元产品标识一并填报。
天 津
天津市药品监督管理局《关于在第二类医疗器械注册申报时提交医疗器械唯一标识有关事项的通知》中要求:
自2022年6月1日起,在我市申请第二类医疗器械首次注册、延续注册或者注册变更时,注册申请人/注册人应当提交其最小销售单元的产品标识。
云 南
早在云南省药监局发布《云南省推进实施医疗器械唯一标识(第一批)工作方案》时,其医疗器械唯一标识实施品种就确定为第三类和部分第二类医疗器械。明确规定了各推进唯一标识的实施步骤及任务与时间节点。
其中,医疗器械注册人需根据产品特点和经营使用需求,选择合适的载体、管理手段与追溯层级,将医疗器械唯一标识应用在全生命周期管理中。并在2021年12月31日前完成。
重 庆
《重庆市药品监督管理局办公室关于实施第二批医疗器械唯一标识工作有关事项的通知》提到:
实施第二批医疗器械唯一标识的注册人要切实落实企业主体责任,按要求做好产品唯一标识赋码、数据库上传等工作。鼓励基于唯一标识建立健全追溯体系,做好产品召回、追踪追溯等有关工作。鼓励和支持我市其他医疗器械品种实施唯一标识,我局将逐步推动第二类医疗器械(含体外诊断试剂)试点实施唯一标识工作。
鼓励和支持我市医疗器械经营企业在经营活动中积极应用唯一标识,做好带码入库、出库,实现产品在流通环节可追溯。
北 京
北京市药监局《关于发布第二类医疗器械(含体外诊断试剂)注册申报事项及资料要求通告》中提到:
提交的产品列表需以表格形式列出拟申报产品的型号、规格、结构及组成、附件,以及每个型号规格的标识(如型号或部件的编号,器械唯一标识等)和描述说明(如尺寸、材质等)。
江 苏
江苏药监局《关于印发江苏省推进医疗器械唯一标识工作实施方案的通知》中提到:
对实施医疗器械唯一标识并完成向国家药品监督管理局唯一标识数据库上传数据等工作的注册人,在申报第二类医疗器械注册及生产许可、第三类医疗器械生产许可时,省药品监督管理局进行单独排序、优先办理。
对实施医疗器械唯一标识并完成向国家药品监督管理局唯一标识数据库上传数据等工作的注册人,相关品种在申请全省医用耗材阳光挂网时予以优先审核办理。
甘 肃
甘肃省药监局印发的《甘肃省推进实施医疗器械唯一标识工作方案》中提到:
2022年6月1日以后生产的第三类医疗器械须提供唯一标识信息后方可纳入省级医药采购平台参与招标采购。
根据产品特点和经营使用需求,选择合适的载体、管理手段与追溯方式,将医疗器械唯一标识应用在全生命周期管理中,确保实施品种范围内的医疗器械在其上市销售前,按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至医疗器械唯一标识数据库,确保数据真实、准确、完整、可追溯。对于已在国家医保局医保医用耗材分类与代码数据库中维护信息的医疗器械,要在唯一标识数据库中补充完善医保医用耗材分类与代码字段。(医疗器械注册人负责,2022年5月20日前完成)
2022年6月1日以后生产的第三类医疗器械在省内经营、储运的,须提供唯一标识信息,并利用唯一标识进行管理。(医疗器械经营企业和第三方物流企业负责,2022年5月20日前完成)
实现唯一标识在医疗器械采购、管理、临床使用等环节的应用,2022年6月1日以后生产的第三类医疗器械无唯一标识信息的,不得进行采购并使用。鼓励市级以下医疗机构应用唯一标识采购、管理第三类医疗器械。
医疗器械注册人围绕唯一标识赋码、上传,提供唯一标识信息以及建立工作流程和管理制度等情况深入总结,提出意见建议,形成书面报告报省药监局。(2022年5月30日前完成)
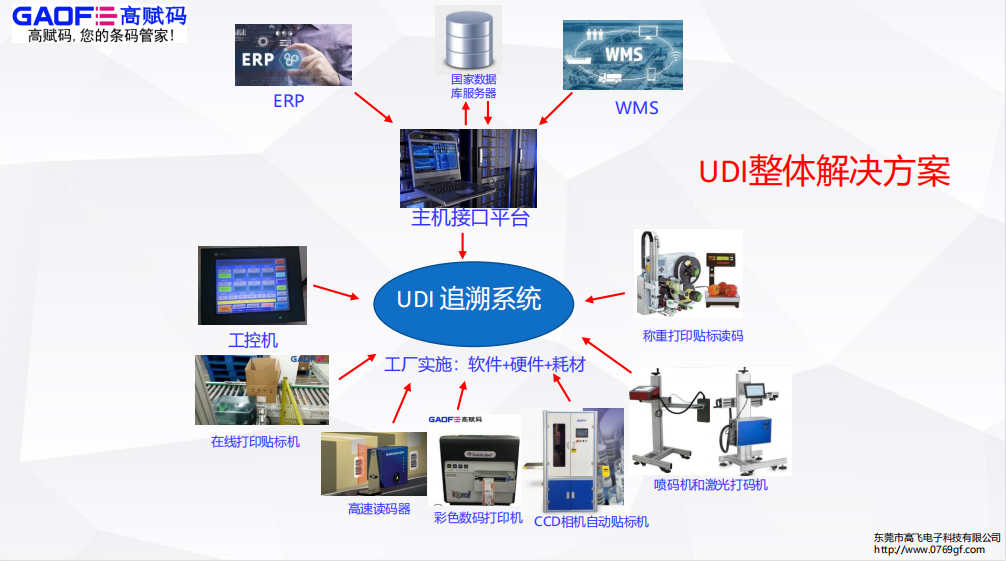
深 圳
《深圳市市场监督管理局 深圳市卫生健康委员会 深圳市医疗保障局关于推进实施医疗器械唯一标识工作的通知》中提到:
我市全部第三类医疗器械生产企业和广东省质量信用A类医疗器械生产企业。同时,鼓励我市第二类、第一类医疗器械注册人/备案人积极参与医疗器械唯一标识实施工作,推动第二类、第一类医疗器械赋码工作。
宁 波
宁波市市场监督管理局印发的《宁波市市场监督管理局全面推进医疗器械唯一标识“赋码溯源” 工作方案》通知中提到:
任务目标一是进一步扩大医疗器械唯一标识的应用范围,实现全市二类以上医疗器械生产企业、三级以上(三甲、三乙)医疗机构全覆盖。
实施品种是全市医疗器械注册人生产的所有第三类、二类医疗器械,鼓励医疗器械注册人、备案人生产的第一类医疗器械参与试点。
2021年11月1日-2022年6月30日。全市所有第二类以上医疗器械生产企业完成唯一标识的赋码、数据库上传和数据维护,三级以上医疗机构实现赋码产品的扫码解析运用。



